renferme, en son centre, un noyau formé
d'un seul corpuscule à charge électrique positive, le proton,
autour duquel gravite, à vitesse très élevée,
un corpuscule 1840 fois plus petit, à charge électrique négative
égale à celle du proton : l'électron. C'est le cas
le plus simple. L'atome d'oxygène est déjà bien plus
complexe : son noyau est formé de 8 protons chargés positivement,
et de 8 neutrons, électriquement neutres. Autour de ce noyau, gravitent
2 électrons sur une orbite rapprochée, et 6 électrons
sur une orbite plus éloignée. Comme ces 8 électrons
sont chargés négativement, l'atome d'oxygène est électriquement
neutre. La liaison entre les deux atomes d'hydrogène et l'atome d'oxygène
se fait par une sorte de mise en commun de certains électrons, et
cet état prend le nom de " covalence ", on le sait, relativement
stable.
Bien entendu, certains atomes peuvent être
bien plus complexes, comme celui d'uranium, par exemple, qui renferme 92
protons, groupés dans le noyau et 92 électrons répartis
en 7 orbites différentes.
Les orbites, outre leur nombre, peuvent
présenter certaines autres caractéristiques, et, pour leur
classification, on adopte actuellement 4 séries d'éléments :
1° Le rang de l'orbite à partir
du noyau : a) rang baptisé " couche K ", b) rang baptisé
" couche L", etc.
2° L'ellipticité de l'orbite.
3° L'orientation qu'elle prend par
rapport à un champ magnétique déterminé.
4° Le sens de rotation des électrons
sur eux-mêmes (ou spin).
Ces 4 éléments constituent
les " nombres quantiques ", et le nombre de
leurs combinaisons est assez grand pour représenter les divers atomes.
Enfin la stabilité des atomes et
des molécules est assurée par des forces de cohésion
de nature diverse, intenses en général dans le cas des noyaux
(association intime des protons et des neutrons), moins fortes en ce qui
concerne le maintien des électrons sur leurs orbites, plus faibles
encore, en ce qui concerne la liaison des atomes dans les molécules,
et celle des molécules entre elles.
C'est à DE BROGLIE (1923) que l'on
doit la notion que les corpuscules constituant les atomes (les électrons
par exemple) sont, comme les photons, associés à des ondes,
sur la nature desquelles on a beaucoup discuté : réalité
physique ? - simple concept mathématique ? - expression d'une probabilité
de position ? Actuellement, les " probabilistes " semblent l'emporter.
En tous cas, cette théorie de l'union : particule matérielle/onde,
est à la base de la " mécanique ondulatoire " qui
s'est révélée fructueuse en chimie physique.
Or, ces mondes miniaturisés que constituent, sans exception, toutes les substances inertes, sont soumis, fréquemment, à des rayonnements,
(d'origine artificielle, ou naturelle
- c'est-à-dire, dans ce dernier cas, très souvent d'origine
solaire). Ils sont donc, en quelque sorte " bombardés "
par une pluie de photons de plus ou moins grande énergie. Dans
le cas spécial d'une exposition aux radiations atomiques, s'ajoutent,
aux photons, des particules de haute énergie (protons, électrons,
neutrons notamment). De toutes façons, des impacts se produisent
avec les cibles mobiles que constituent les électrons atomiques
ou moléculaires, en perpétuel mouvement sur leurs orbites
habituelles et avec les noyaux. Il en résulte des effets des
plus variés.
Suivant l'énergie des photons,
on peut constater :
1° une simple accélération
de l'agitation thermique des molécules, agitation constante dans
tous les corps à une température un peu éloignée
du zéro absolu. Cet effet est très souvent enregistré,
puisqu'un seul photon rouge absorbé par une molécule peut
lui communiquer une agitation égale à 50 fois celle qu'elle
a normalement à une température de 15/20°C ;
2° le déplacement d'un
électron sur une orbite plus éloignée que celle
qu'il occupe habituellement. En général, un photon de
lumière visible possède théoriquement une énergie
suffisante pour réaliser cette modification de l'état
électronique des atomes, ou des molécules, qui prennent
ainsi un état dit " excité ". Mais il faut que
l'énergie du photon corresponde à celle qui est nécessaire
au déplacement de l'électron sur sa nouvelle orbite. L'énergie
est libérée quand l'électron regagne, en une ou
plusieurs fois, son orbite primitive ;
3° l'arrachement d'un électron
à l'attraction du noyau de son atome, ou des noyaux de la molécule.
Pour ce faire, il faut, et suivant les cas, des photons (ou des particules)
d'une énergie supérieure à 3 ... 20 eV. Seuls donc,
certains rayons ultraviolets peuvent, parfois, provoquer cette modification
importante que l'on appelle " ionisation ". Cet effet peut,
du reste, être obtenu aussi par d'autres voies. La molécule
ionisée ayant perdu l'un de ses électrons (négatif),
se trouve électriquement déséquilibrée ;
4° l'éclatement du noyau,
et donc la dislocation complète de l'atome. Cet effet n'est atteint,
en général, qu'avec des particules de très haute
énergie produites, par exemple, par la radioactivité naturelle
ou artificielle.
Bien d'autres effets peuvent être observés, mais le cas 2° (déplacement d'un électron, d'une orbite sur une autre, par un photon d'énergie modérée) se rencontre fréquemment dans les phénomènes photochimiques (Fig. 2). En effet, quand l'électron déplacé regagne son orbite primitive, il libère l'énergie qu'il a emmagasinée. S'il appartient à une molécule complexe, celle-ci peut se fractionner en parties plus petites. Elle peut devenir réductrice (prendre à l'une de ses voisines un ou plusieurs atomes d'oxygène). Parfois, certains corps exposés à la lumière deviennent conducteurs d'électricité et il en résulte divers
effets, comme une action catalytique photochimique. On rencontre aussi des phénomènes d'émission de lumière de longue durée (dits de phosphorescence) - ou de courte durée (fluorescence), etc.
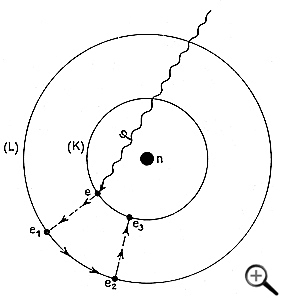
FIG 2 - Effet photochimique
(cas simple). - Autour d'un noyau n, gravite un électron e, sur
son orbite (K). Sous l'action d'un photon extérieur phi, cet électron
est placé sur une orbite plus éloignée (L). En revenant
sur l'orbite (K), il libère de l'énergie, origine de l'effet photochimique.
Le photon, quant à lui, a disparu.
Plus simplement, dans de nombreux
cas, on ne constate aucun effet des genres précédents ;
le seul résultat appréciable est un échauffement
du corps exposé à la lumière.
Dans la pratique photochimique, on savait depuis longtemps que certains colorants " passaient " à la lumière. Cette transformation est industriellement importante et elle a été bien étudiée. La laine, par exemple, jaunit sous certains rayons (ultraviolets), et blanchit sous d'autres (de couleur bleue). En chimie, on avait constaté que l'hydrogène et le chlore se combinaient de façon explosive, dans un ballon transparent, quand il était exposé à la lumière solaire. À la lumière diffuse, la réaction était bien plus lente. Au début de ces expériences, on les considérait comme de simples curiosités de laboratoire, mais le développement foudroyant de la photographie et de ses multiples applications a suscité, dans cette direction, des études de plus en plus poussées. Des " lois photochimiques " ont été élaborées et des découvertes très intéressantes ont été effectuées: celle des substances photosensibilisantes notamment. Un corps, dont les propriétés chimiques varient très peu, ou même pas du tout, quand il est exposé à certaines radiations, peut voir son comportement modifié du tout au tout, quand on adjoint au système une nouvelle substance, dite photosensibilisante, qui capte l'énergie desdites radiations et la transfère au corps jusqu'alors insensible. Cette notion nouvelle a reçu de nombreuses applications, en photographie notamment, pour la mise au point des substances photosensibles actuelles.